林金星教授团队在植物膜蛋白动态计算方面发表高质量综述论文
近日,北京林业大学林木分子设计育种高精尖创新中心和生物学院林金星教授受邀在植物学权威学术期刊Annual Review of Plant Biology撰写题为 “Exploring the Spatiotemporal Organization of Membrane Proteins in Living Plant Cells”的综述文章 (IF=22.8),对在活体状态下植物膜蛋白动态、聚合状态及蛋白互作的单分子分析技术进行了总结,对这些单分子分析技术在植物生物学中的应用进行了深入探讨,并提出了有效的分析方法。
植物膜蛋白在物质转运和信号转导过程中发挥重要作用,但在活体条件下研究和分析膜蛋白的动态过程、分子间相互作用则非常困难。林金星教授研究团队率先建立了适合于植物活细胞观察的单分子分析平台,实现了在体、原位条件下膜蛋白聚合状态以及蛋白互作的纳米和毫秒级的实时动态检测。十多年来,通过单分子技术相继对植物中的PIP2;1 (Li et al., Plant Cell, 2011), Flot1 (Li et al., Plant Cell, 2012), AMT1;3 (Wang et al., PNAS, 2013), AP2 σ (Fan et al., Development, 2013), Phot1 (Wan et al., Plant Cell, 2014), RbohD (Hao et al., Plant Cell, 2014), BRI1 (Wang et al., Molecular Plant, 2015) 等膜蛋白的扩散和驻留时间等动态参数进行了检测和分析。此外, 还通过优化单分子技术,分析了活体状态下膜蛋白的聚合状态 (Wang et al., Nature Protocols, 2015),并建立了一些重要细胞器膜蛋白的单分子检测技术方法 (Lv et al., Molecular Plant, 2017)。在过去这些研究的基础上,该综述着重分四部分评述了植物膜蛋白单分子研究技术,包括标记技术、单分子成像技术、膜蛋白聚合体和互作的动态计算方法,以及这些技术在植物生物学领域的应用。
由于单个分子的荧光很弱,并且容易受到背景噪音的干扰,因此要实现单分子成像,对膜蛋白进行有效标记至关重要。该综述的第一部分除了介绍常规的标记方法,譬如小分子染料和纳米荧光颗粒标记(量子点QD)等技术外,还重点叙述了荧光蛋白的标记(如GFP、mCherry、DsRed-E5、光激活蛋白PA-GFP和Dronpa),以及它们在实际应用中需要注意的问题。
第二部分阐述了标记后蛋白的单分子追踪和成像技术,包括激光共聚焦显微镜、超高分辨显微镜和宽场显微镜等。虽然常规的共聚焦显微镜的分辨率不能达到单分子检测要求,但如果配置高灵敏度的检测器,结合相应的分析系统,譬如荧光相关光谱(FCS)、荧光互相关光谱(FCCS)和荧光能量共振偏移(FRET)技术等,也可以实现对单分子的追踪、动态分析以及膜蛋白状态的检测。该综述除了介绍2014年诺贝尔化学奖授予的超分辨显微术(STED、STORM、PALM等)以外,重点介绍了适合于植物细胞膜蛋白分析的可变角度-全内反射荧光显微镜(VA-TIRFM)的原理及其应用。
综述的第三部分详细介绍了在标记和成像基础上,测定膜蛋白聚合状态和动力学特征的主要方法:(1)通过荧光强度的分析技术,包括FIDA、PCH、SpIDA技术;(2)通过荧光漂白的分析技术,包括smSubunit-counting和smFRAP技术;(3)通过荧光涨落及荧光共振能量转移的分析技术,包括FCS/FCCS、FRET-FLIM技术;(4)通过蛋白共定位和相互作用的分析技术,包括单分子水平的蛋白接近指数分析技术(smPPI)和单分子水平的pull-down 技术。
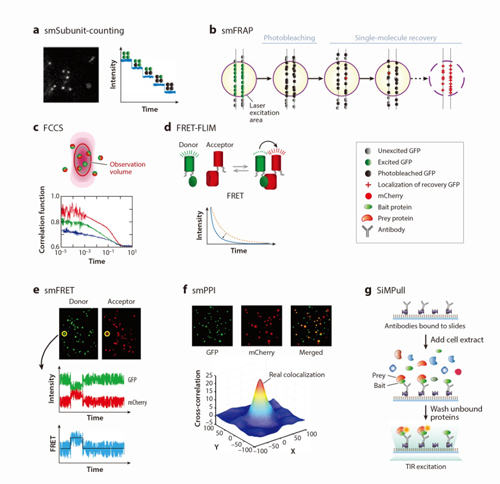
图1植物细胞中膜蛋白聚合状态的动态计算技术模式图
综述的最后一部分简要叙述了在信号传导过程中,单分子技术用于检测膜蛋白聚合与活化状态、动态变化与膜筏关系、动力学特征与细胞骨架关系,以及不同环境条件下膜蛋白密度、驻留时间、胞吞途径和转运速率、细胞骨架和细胞壁对膜蛋白聚合体形成的动态调控等方面的应用,为植物膜蛋白的研究提供了新思路。
该综述已于4月6日在线发表(https://doi.org/10.1146/annurev-arplant-042817-040233)。林金星教授为论文的通讯作者,该团队成员、现为扬州大学副教授王莉为论文的第一作者,团队成员薛轶群、邢晶晶和宋凯博士为论文的其他作者。该论文得到了北京林木分子设计育种高精尖创新中心和国家自然科学基金重点项目的资助。


